在认知神经科学迅速发展的今天,功能性近红外光谱(fNIRS)正逐渐成为非侵入式脑成像领域的重要力量。然而,要实现其科研与临床价值的最大化,“空间配准”成为一道绕不开的技术门槛。我们在论文中常见的AAL图谱、Brodmann分区、Talairach坐标系、MNI152模板到底指的是什么?经典的10-20、10-10、10-5系统之间又有何区别?它们是如何被应用到fNIRS的空间配准中的?
今天,我们通过一篇发表于 NeuroImage(2014)的经典研究,带你系统梳理fNIRS空间配准的基础知识与关键技术。无论你是新手入门,还是希望优化自己的研究方法,这篇推文都将为你打开理解fNIRS空间定位机制的大门,助你在数据解读与成果发表的道路上走得更稳、更远。
本文全长约1.2万字。
目录
一、fNIRS 技术概述
(一)fNIRS 的基本原理
(二)fNIRS 的技术优势
(三)fNIRS 的应用领域
二、空间配准的必要性
三、标准立体定向坐标系
(一)早期的大脑图谱
(二)现代平均脑模板
(三)概率性宏观解剖模板
(四)其他数据标准化方法
四、描述头皮位置的方法
(一)国际 10 – 20 系统
(二)10 – 10 系统和 10 – 5 系统
(三)头皮位置与 MNI 空间的对应
五、fNIRS 数据与结构图像的配准
(一)个体数据配准
(二)群体数据配准
六、概率配准
七、概率配准在 DOT 中的应用
八、虚拟配准
九、软件实现
十、儿童与婴儿数据配准
十一、结语
十二、关于作者
續木大介
檀一平太及其实验室信息
一、fNIRS技术概述:照亮大脑活动的“光”
(一)fNIRS的基本原理
fNIRS技术的诞生,源于对大脑活动与血流动力学之间紧密联系的深入洞察。当大脑特定区域被激活时,该区域的神经元活动会引发一系列生理变化,其中最为显著的便是局部脑血流增加,同时伴随着血红蛋白氧合状态的改变。fNIRS技术巧妙地利用了血红蛋白对近红外光的独特吸收特性,通过向头皮发射近红外光,并测量经头皮和脑组织散射后返回的光强度变化,从而间接获取大脑皮层的血液动力学信息,以此来推断大脑的功能活动情况。
简单来说,当大脑某区域活跃时,该区域的氧合血红蛋白含量会增加,脱氧血红蛋白含量相应减少。而氧合血红蛋白和脱氧血红蛋白对近红外光的吸收程度不同,fNIRS设备通过检测这种光吸收的差异,就能捕捉到大脑活动的蛛丝马迹。这就好比给大脑戴上了一副“光感眼镜”,让我们能够“看”到大脑内部的活动变化。
(二)fNIRS的技术优势
相较于其他神经成像技术,fNIRS凭借其独特的优势,在神经科学研究领域中占据了一席之地。
首先,fNIRS设备具有体积小巧、便携性强的特点。它摆脱了传统大型成像设备对实验场地的严苛限制,研究人员可以轻松地将其带到各种自然场景中进行实验,例如学校教室、家庭环境甚至户外场所。这使得在真实生活情境下研究大脑功能成为可能,能够获取到更为自然、真实的大脑活动数据。
其次,fNIRS操作简便,对受试者的要求相对较低。受试者无需像进行磁共振成像(MRI)那样,长时间保持静止不动的状态,也无需担心强磁场带来的不适或风险。这不仅降低了受试者的参与门槛,还使得fNIRS能够适用于更广泛的人群,包括儿童、老年人以及患有某些疾病无法进行MRI检查的特殊人群。
再者,fNIRS具有良好的时间分辨率。它能够实时捕捉大脑活动的动态变化,为研究人员提供关于大脑功能活动的实时信息。这对于研究快速发生的认知过程,如注意力的瞬间转移、情绪的快速波动等,具有重要的意义。
(三)fNIRS的应用领域
凭借上述优势,fNIRS在众多领域展现出了巨大的应用潜力。
在认知神经科学领域,fNIRS成为了研究人员探索人类高级认知功能的有力工具。通过让受试者执行各种认知任务,如记忆测试、语言理解与表达任务、注意力集中训练等,同时利用fNIRS监测大脑特定区域的活动变化,研究人员可以深入了解大脑在这些认知过程中的工作机制。例如,研究发现,在进行记忆编码和回忆任务时,大脑的海马体和前额叶皮层会出现明显的fNIRS信号变化,这表明这些区域在记忆过程中发挥着关键作用。
在临床医学领域,fNIRS也发挥着重要的作用。它可以用于脑损伤、中风、阿尔茨海默病等神经系统疾病的早期诊断和病情监测。通过监测大脑特定区域的血流和氧合变化,医生能够及时发现大脑功能的异常,为疾病的早期干预和治疗提供重要依据。此外,fNIRS还可以用于评估康复治疗的效果,帮助医生调整治疗方案,提高患者的康复质量。
二、空间配准的必要性:给大脑活动精准“定位”
尽管fNIRS技术在神经科学研究中取得了一定的成果,但它也面临着一个亟待解决的关键问题——缺乏结构信息。简单来说,fNIRS虽然能够检测到大脑皮层的活动变化,但却无法准确确定这些活动发生在大脑的具体位置。这就好比我们听到了远处传来的声音,却无法判断声音的来源方向和具体位置一样。
在神经科学研究中,准确确定大脑活动的位置至关重要。不同的大脑区域具有不同的功能,只有将大脑活动与具体的解剖结构相对应,才能深入理解大脑的工作机制,揭示神经活动与认知、行为之间的内在联系。例如,当我们研究语言功能时,需要知道大脑中哪些区域参与了语言的产生、理解和表达过程,以及这些区域之间是如何相互协作的。如果无法准确确定大脑活动的位置,就难以对研究结果进行准确的解释和分析。
为了解决这一问题,空间配准技术应运而生。空间配准的核心目标,就是建立起fNIRS测量的头皮位置与大脑皮层表面实际功能区域之间的精确对应关系。通过空间配准,我们可以将fNIRS数据与大脑的解剖结构信息相结合,从而在大脑的“地图”上为每一个大脑活动找到其准确的“坐标”,实现对大脑活动的精准“定位”。这对于深入研究大脑功能、推动神经科学的发展具有至关重要的意义。
三、标准立体定向坐标系:大脑研究的“通用地图”
在神经科学研究中,为了实现不同个体之间大脑数据的比较和整合,需要一个统一的标准来描述大脑的位置和结构。这就好比地球上各个国家使用统一的经纬度来确定地理位置一样,大脑研究领域也需要一个“通用地图”,这就是标准立体定向坐标系。
(一)早期的大脑图谱
早期,Brodmann图谱的出现为大脑解剖学研究奠定了坚实的基础。Brodmann通过对大脑皮层细胞化学结构的细致研究,将大脑皮层划分为约50个不同的区域。这些区域具有独特的细胞组成和结构特征,为后来的大脑功能研究提供了重要的解剖学参考。Brodmann图谱虽然是基于二维的描述,但在很长一段时间内,它一直是神经科学家们研究大脑结构和功能的重要依据。
随着技术的不断发展,Talairach图谱应运而生。Talairach图谱基于对一个老年白人女性大脑的深入研究,引入了立体定向坐标系。这个坐标系使得大脑的主要解剖结构能够在通用的三维空间中进行精确描述,并且涵盖了所有的Brodmann区域。Talairach图谱的出现,为大脑研究提供了更为精确和统一的标准,被广泛应用于fMRI分析软件中,成为了神经科学研究领域的重要工具。
(二)现代平均脑模板
然而,Talairach图谱存在一定的局限性,它基于单个个体的大脑,无法完全代表人类大脑的多样性和变异性。为了弥补这一缺陷,现代平均脑模板逐渐发展起来。其中,MNI152平均脑模板是目前应用最为广泛的一种。它通过对152个不同个体的大脑进行配准和平均,构建出了一个能够更广泛代表人类大脑总体结构的模板。MNI152模板的出现,为神经科学研究提供了一个更为客观和通用的标准,被广泛应用于SPM等统计分析软件中。
为了更方便地获取MNI空间中的解剖学信息,基于Colin27标准大脑的自动解剖标记(AAL)工具应运而生。AAL工具以MNI空间中的坐标为基础,对Colin27大脑的宏观解剖结构进行了详细的标注。研究人员可以通过输入特定的坐标,快速获取该位置对应的宏观解剖结构信息,如所属的脑区、脑回等。此外,还有针对Talairach坐标系的Talairach Daemon工具,它们都为研究人员在大脑解剖学研究中提供了极大的便利。
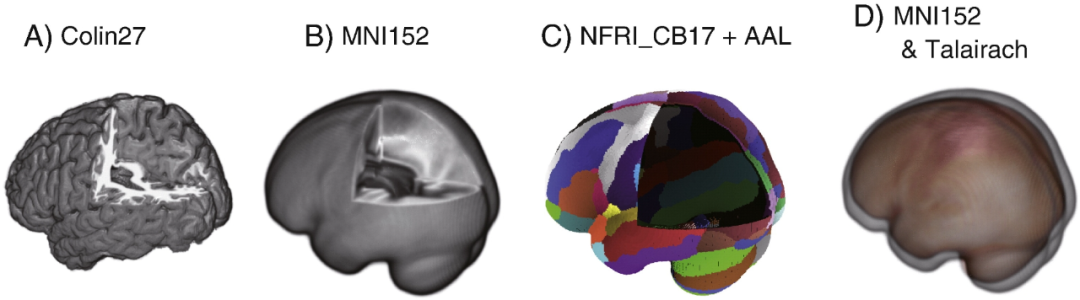


标准大脑之间的对比。所有标准大脑都排列在同一角度,并从同一角度进行观察。(A)带有宏观解剖信息的Colin27大脑模型。(B)由于经过平均处理,皮层结构较为平滑的 MNI152 模板。(C)为功能性近红外光谱(fNIRS)数据配准而优化的日本国立食品研究所标准大脑 17 号(NFRI_CB17)。皮层表面被压缩成单层,形成一个壳状结构,在这里,像宏观解剖图谱和 10/20 定位点这类额外的结构信息可以进行配准。在这种情况下,叠加了一个经过模式过滤的自动解剖标记图谱(AAL)。(D)排列在同一坐标系中的 MNI 模板和 Talairach 模板。尽管它们的形状相似,但 Talairach 模板要稍小一些。
(三)概率性宏观解剖模板
尽管AAL和Talairach Daemon工具在大脑解剖学研究中发挥了重要作用,但它们仍然存在一定的局限性。由于它们都是基于单个个体的大脑,无法充分考虑个体之间的解剖学差异。为了更准确地描述大脑解剖结构的概率性和变异性,概率性宏观解剖模板LPBA40应运而生。LPBA40基于40个个体的大脑,在脑回水平进行了宏观解剖分割,能够提供更为丰富和准确的概率性宏观解剖信息。这使得研究人员在研究大脑结构和功能时,能够更好地考虑个体差异,提高研究结果的准确性和可靠性。
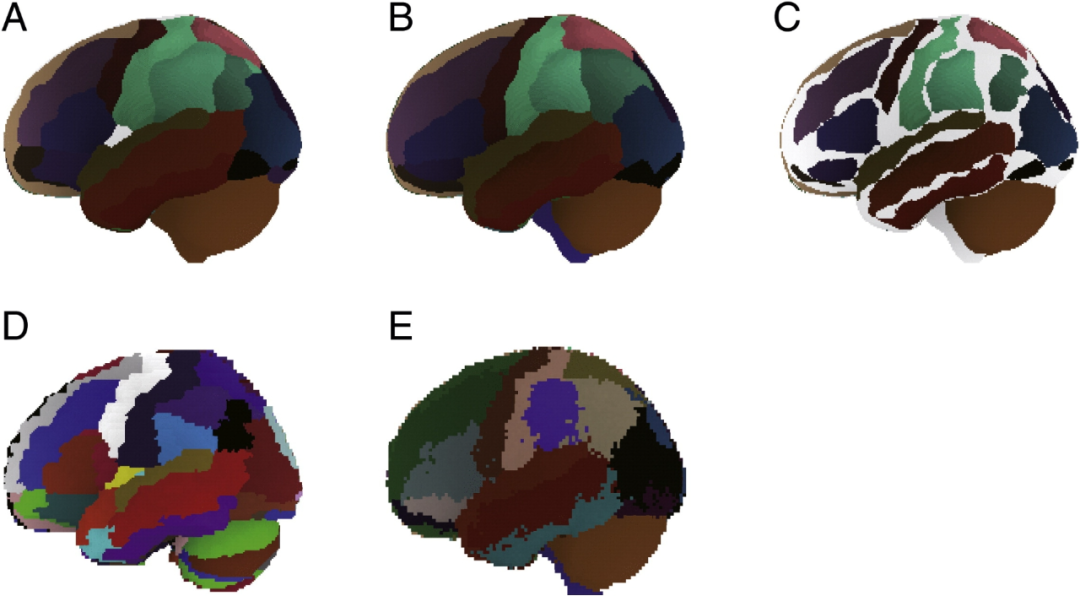


MNI 空间中宏观解剖图谱之间的对比。(A)基于 Colin27 的宏观解剖分割的自动解剖标记图谱(AAL)经过模式过滤,并投影到日本国立食品研究所标准脑 17 号(NFRI_CB17)上,以用于功能性近红外光谱(fNIRS)空间配准。一些区域被整合起来,以保持与 LPBA40 中的宏观解剖分割的兼容性。(B)基于 40 名受试者的概率性宏观解剖分割的 LPBA40 图谱经过模式过滤,并投影到 NFRI_CB17 上,以用于 fNIRS 空间配准。(C)AAL 图谱和 LPBA40 图谱相互重叠。共同标记的区域用不同颜色描绘。LPBA40 中 64.6% 的宏观解剖标记体素(42452/65745)与 AAL 的体素重叠,而 AAL 中 69.2% 的宏观解剖标记体素(42452/61349)与 LPBA40 的体素重叠。(D)未平滑处理的原始 AAL 图谱。(E)未平滑处理的原始 LPBA40 图谱。
同时,MNI152模板也在不断发展和改进。ICBM152NLin通过非线性迭代变换,保留了主要的脑沟结构,使得模板更加接近真实的大脑形态。然而,目前它在宏观解剖学标签资源方面还存在一定的不足,需要进一步的完善和补充。
(四)其他数据标准化方法
除了上述的标准脑模板和工具外,还有一些其他的数据标准化方法在神经科学研究中得到了应用。其中,Freesurfer软件是一种常用的数据标准化工具。它通过对大脑进行分割、展开和变形等处理,将大脑结构映射到一个标准的大脑形状上,使得研究人员能够更直观地观察和分析大脑的宏观解剖结构。Freesurfer软件与DOT技术具有较高的亲和力,在一些fNIRS研究中得到了应用,为fNIRS数据的标准化提供了新的选择。
将fNIRS数据展示在这些标准坐标系中,能够实现不同个体、不同研究以及不同模态数据之间的比较和整合。然而,由于技术上的一些困难,目前在这些通用立体定向空间中展示fNIRS数据还尚未成为一种普遍的做法。研究人员仍在不断探索和改进相关技术,以推动fNIRS数据在标准坐标系中的广泛应用。
四、描述头皮位置的方法:搭建颅 – 脑结构的“桥梁”
在fNIRS研究中,当无法获取MRI结构图像时,如何准确描述头皮位置,建立颅 – 脑结构之间的对应关系,成为了实现空间配准的关键问题。目前,国际10 – 20电极放置系统是最为常用的方法之一。
(一)国际10 – 20系统
国际10 – 20系统最初是为脑电图(EEG)头皮电极定位而设计的,由于其具有良好的可靠性和可重复性,在fNIRS研究中也得到了广泛的应用。该系统通过确定颅骨上的几个关键标记点,如鼻根(Nz)、枕外隆凸(Iz)以及左右耳前点(RA、LA),然后以这些标记点为基础,按照10%或20%的间距在头皮上系统地设置其他标记点。通过这种方式,国际10 – 20系统能够准确地描述头皮上各个位置的相对坐标。
多项研究通过使用尸体解剖、X射线、CT扫描以及MRI等多种技术手段,验证了国际10 – 20系统中头皮位置与下方脑结构之间存在着较为稳定和一致的对应关系。这使得研究人员可以利用这些对应关系,将fNIRS测量的头皮位置与大脑皮层的功能区域进行初步的关联。例如,研究发现,在国际10 – 20系统中,F3位置下方对应的大脑区域通常与额叶的功能活动密切相关。
(二)10 – 10系统和10 – 5系统
随着神经科学研究的不断深入,对头皮电极定位的精度要求也越来越高。为了满足这一需求,在国际10 – 20系统的基础上,10 – 10系统和10 – 5系统应运而生。
10 – 10系统在国际10 – 20系统的基础上,进一步增加了电极位置的密度,定义了81个电极位置。它通过更细致的间距设置,能够更精确地描述头皮位置,提高了对大脑皮层功能区域的定位精度。10 – 10系统的修改形式已经被美国临床神经生理学会(ACNS)和国际临床神经生理学会(IFCN)接受为标准,在神经科学研究中得到了广泛的应用。
10 – 5系统则在10 – 10系统的基础上,进一步提高了电极密度,具有300多个电极位置。它能够提供更高分辨率的头皮位置信息,对于研究大脑皮层的精细功能具有重要意义。然而,由于电极密度过高,在实际应用中也面临一些挑战,例如在枕部区域,由于电极过于密集,可能会导致头皮位置的分辨困难。


10–20 系统的点位用深灰色圆圈表示,10–10 系统的点位用浅灰色圆圈表示,10–5 系统的点位用灰色圆点表示。
(三)头皮位置与MNI空间的对应
为了将头皮位置与标准的MNI坐标系统建立联系,研究人员进行了大量的研究工作。通过将10 – 20位置、10 – 10位置以及10 – 5位置投影到Brodmann图谱上,研究人员建立了头皮位置与宏观解剖结构之间的对应关系。同时,通过数学变换和模型构建,将这些头皮位置与MNI坐标系统进行了关联。
然而,这种对应关系在直观理解上存在一定的困难。为了解决这一问题,Cutini等人创建了真实的MNI152大脑和头部模型。研究人员可以通过在这个真实模型上滑动实际的fNIRS探头支架,进行探头定位和实时映射模拟。这种方法使得头皮位置与MNI空间的对应关系变得更加直观和易于理解,为fNIRS研究提供了更为便捷的工具。
五、fNIRS数据与结构图像的配准:实现精准“对接”
(一)个体数据配准
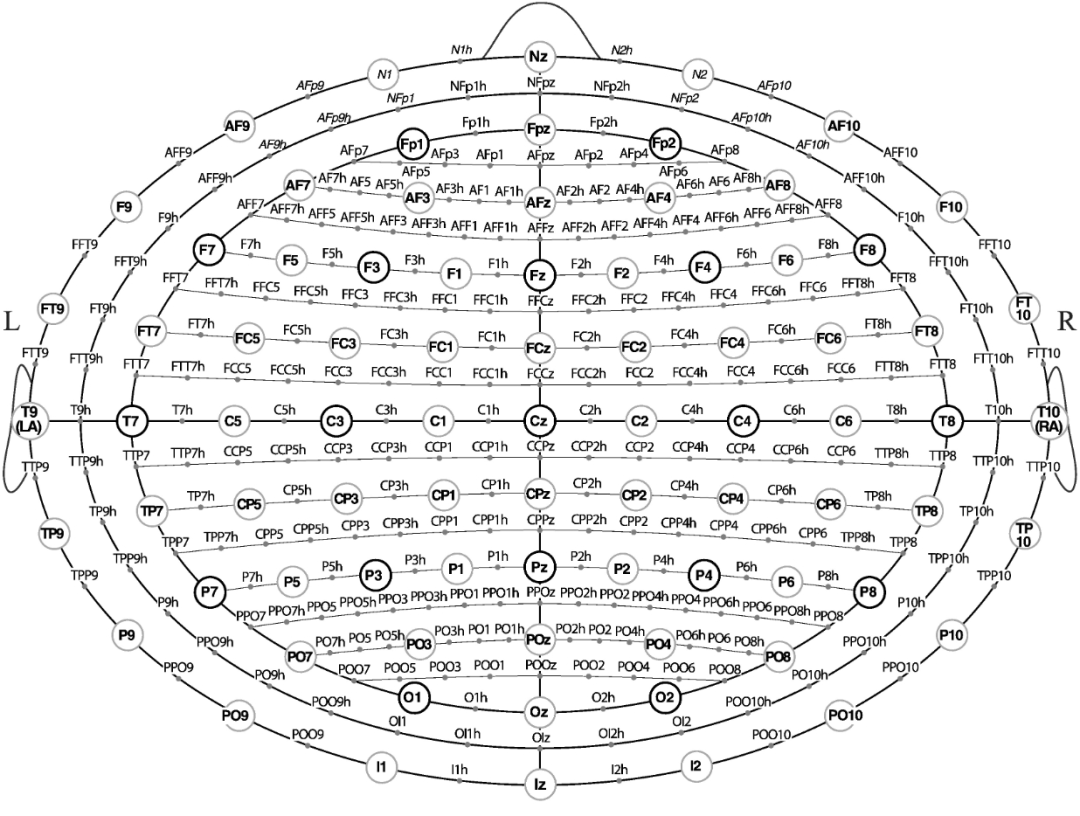
当研究人员能够获取受试者的MRI结构图像时,可以将fNIRS数据与受试者自身的结构MRI进行配准。这一过程就像是为fNIRS数据找到了一个精确的“定位锚点”,使得fNIRS数据能够在大脑的解剖结构上进行准确的定位和展示。
一种常用的方法是在头皮上放置标记物,如维生素E胶囊或松子珠等,然后与标记物一起进行结构MRI扫描。这样,在MRI图像上就可以清晰地看到标记物的位置,从而直接确定fNIRS探头或通道在大脑中的位置。这种方法简单直接,但需要注意标记物的放置位置和数量,以确保能够准确地反映fNIRS探头的位置。
另一种更为常用的方法是使用三维(3D)数字化仪。首先,使用3D数字化仪记录fNIRS探头或通道在头皮上的位置,同时记录至少三个头皮标记点的位置,通常选择双侧耳前点和鼻根作为标记点。这些标记点在头皮和MRI图像上都能够清晰地识别。然后,通过刚体变换,包括旋转和平移操作,将fNIRS探头或通道的位置转换到MRI空间中。通过这种方法,可以精确地将fNIRS数据与受试者的结构MRI进行配准。
在将探头或通道位置转换到MRI空间后,fNIRS数据可以以不同的形式进行展示。一种方式是将其表示为离散的通道数据,即将功能数据,如氧合血红蛋白的相对信号变化,与每个通道进行绑定。另一种方式是通过插值算法,创建连续的地形图像,使得大脑的功能活动以更直观的方式呈现出来。然而,这些数据最初都是位于头皮层面的,为了更准确地反映大脑皮层的功能活动,需要将数据投影到皮层表面。
数据投影到皮层表面的方法有多种,例如可以通过寻找距离给定头皮点最近的皮层点,将数据投影到该点上;也可以从头皮点的切平面画垂直线,将数据投影到与垂直线相交的皮层点上;还可以向大脑中心位置,如大脑质心画线,将数据投影到相应的皮层点上。此外,还可以基于头部和脑组织的光学特性,采用光子测量密度函数,对每个由源 – 探测器对组成的通道进行三维功能图像的重建。通过这些方法,可以更准确地估计信号源在大脑皮层上的分布,实现fNIRS数据在皮层上的精准定位。


将基于通道的个体功能性近红外光谱(fNIRS)数据配准到受试者自身的结构图像上。(A)使用三维数字化仪在真实世界坐标系中测量头皮上的多通道 fNIRS 通道(蓝色圆点)和头皮参考标记点(黑色圆点)的位置。Nz 代表鼻根;AL 代表左耳前点;AR 代表右耳前点,位于头部的另一侧。(B)使用磁共振成像(MRI)在另一个真实世界坐标系中获取头部和大脑的结构图像。同时手动识别三个头皮标记点(红色方块;其中一个在头部另一侧)。(C)使用刚体变换将三维数字化的头皮参考标记点(黑色圆点)合并到磁共振成像(MRI)上相应的标记点上:由此,fNIRS 的位置也得到了变换,并与受试者自身的 MRI 共同配准。(D)最后,将头皮上的 fNIRS 通道投影到皮层表面(进行了平滑处理,以便更清晰可见)。
(二)群体数据配准
在群体研究中,将多个个体的fNIRS数据整合到标准大脑空间,对于挖掘群体大脑功能的共性与差异意义非凡。然而,不同个体的大脑在结构和功能上存在天然差异,这给数据整合带来了诸多挑战。
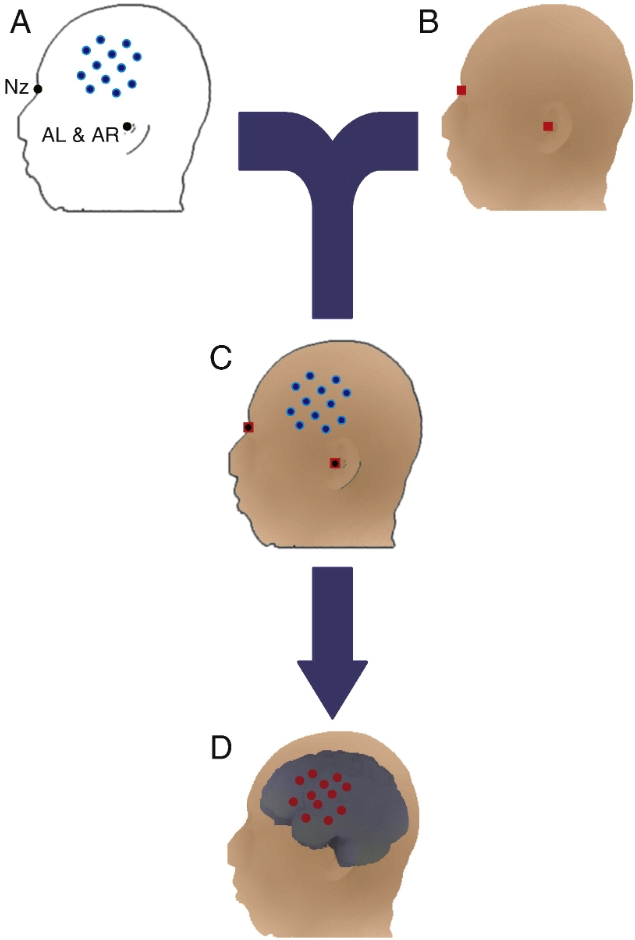
在进行通道分析时,第一步是把每个个体的fNIRS通道位置转换为与结构MRI兼容的真实世界坐标。随后,借助SPM软件等工具,对个体的MRI头部图像实施空间归一化操作,使其与MNI标准脑模板的形状、大小相匹配。在这个过程中,会生成一个变形场矩阵,它记录了从个体MRI空间到MNI空间的变换信息。
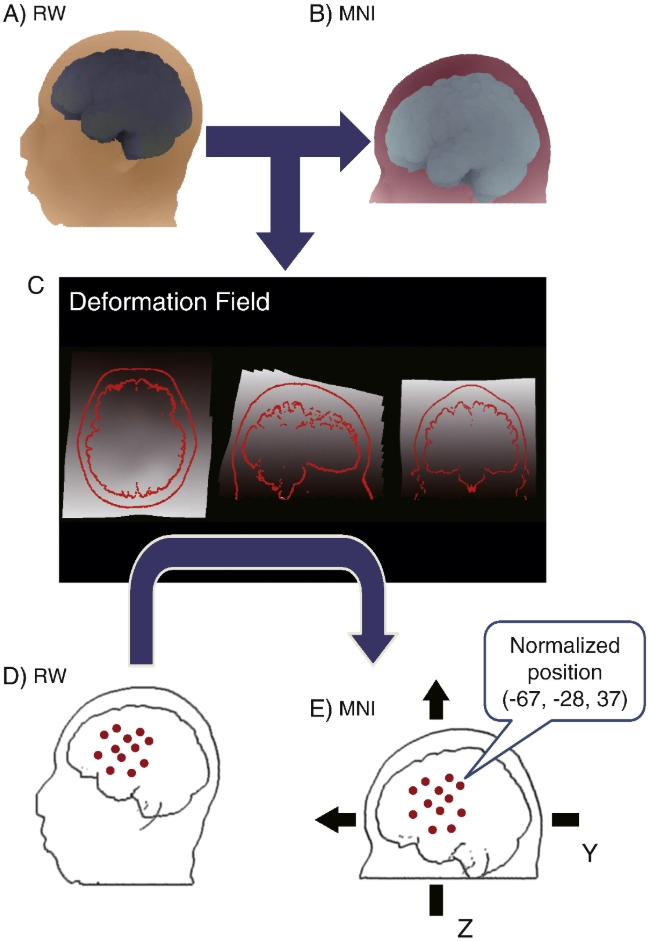
接着,将逆变形场矩阵应用到fNIRS探头、通道位置及其皮层投影上,就能得到这些位置在MNI空间的坐标值。把多个个体在MNI空间的通道位置进行平均,可得到最具代表性的MNI坐标值,实现群体数据在标准大脑空间的初步整合。


将基于通道的个体功能性近红外光谱(fNIRS)数据归一化到标准脑空间。使用统计参数映射(SPM)程序,将处于真实世界(RW)坐标系中的受试者自身的磁共振成像(MRI)图像(图 A)归一化至 MNI 152 模板,使其能够在 MNI 空间中呈现(图 B)。提取反映从真实世界空间到 MNI 空间的扭曲变换矩阵的变形场(图 C)。利用该变形场,将处于真实世界空间中的离散 fNIRS 通道位置数据(图 D)变换到 MNI 空间(图 E)。最终,每个 fNIRS 通道的坐标值都能在 MNI 空间中获取(Matlab 工具箱可在http://www.jichi.ac.jp/brainlab/tools.html获取)。


在 MNI 空间中整合基于通道的多受试者功能性近红外光谱(fNIRS)数据。经过前面所述的流程后,每位受试者基于通道的 fNIRS 数据都能在 MNI 空间中呈现。通过重复这一过程,多受试者的数据便可在 MNI 空间中获取(图 A)。这些数据在 MNI 空间中进行汇总(图 B),其中通道位置的坐标经过平均计算,得出最可能的通道位置(圆圈的中心),并以综合标准差来表示数据的变异性(圆圈的半径)。颜色按照热图色谱表示激活程度(红色表示激活程度较高,绿色表示激活程度较低)。
但在转换过程中,由于个体差异,同一头皮位置在不同个体大脑中的皮层投影点会有所不同,进而产生误差。为衡量误差大小,研究人员常用沿x、y、z轴的标准差或综合标准差(cSD)等变异性统计指标。在成人的典型多通道测量里,cSD一般在几毫米到十几毫米之间。这表明,在通道密度不高且测量不重叠时,不同通道虽能大致对应单个脑回或Brodmann区域,但误差依然存在。
当通道数量增多,个体头部形状和大小的差异会使通道放置的可重复性降低,通道独立性难以保障。此时,将多通道数据整合到感兴趣区域(ROI)是个可行办法。比如,若不同个体在左侧角回区域的通道数量不同,可将这些通道数据分别分组,代表该区域在不同个体中的功能状态。这样能在一定程度上解决通道放置差异的问题,更聚焦于宏观解剖区域的功能研究。
对于连续图像数据的群体分析,情况更为复杂。由于个体头皮形状和大小不同,连续图像数据的形状、大小和方向也会各异。虽然NIRS-SPM软件包可调整数据重叠程度,但如何更有效地处理重叠区域,仍是研究人员需要深入探索的课题。目前,通常选择所有受试者共有的中心区域进行分析,以确保数据的稳定性和可比性。
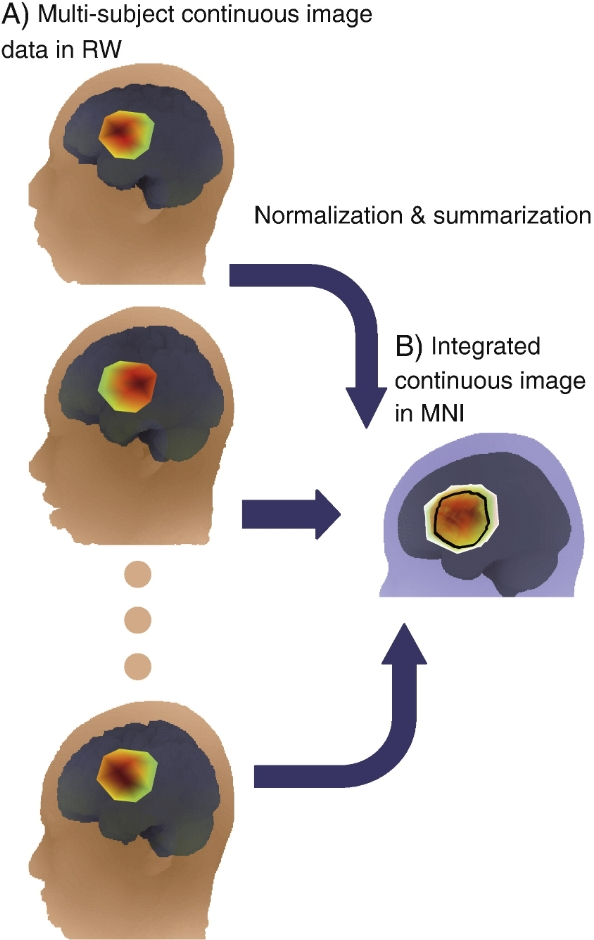


在MNI空间中整合功能性近红外光谱(fNIRS)的连续图像数据。针对每位受试者,使用插值法或图像重建法在真实世界(RW)空间中创建一幅连续图像(图A)。将每幅图像归一化到MNI空间,并相互求平均值,从而在MNI空间中得到一幅整合后的连续图像(图B)。外边缘表示至少有一位受试者覆盖的区域,内部黑色边界表示所有受试者(在这个模拟数据中有15位受试者)都覆盖的区域。颜色按照热图色谱表示激活程度(红色表示激活程度较高,绿色表示激活程度较低)。
另外,连续图像在标准空间中的有效空间分辨率也是个关键问题。fNIRS数据重建后的有效分辨率大于实际实验分辨率,这意味着功能推断会受到解剖标记工具分辨率的限制。因此,通过设置ROI进行分析,成为实现连续fNIRS图像稳健功能推断的常用方法。研究人员既可以依据中心坐标值来提取ROI内的体素,也可以参考宏观解剖图谱进行分析。但要注意,不同的ROI设置方式会对分析结果产生影响,在实际应用中需要谨慎选择。
六、概率配准:突破局限的新路径
在实际研究中,MRI扫描仪并非随处可得,而且同时使用fNIRS和MRI会增加实验成本,给受试者带来更多负担。为解决这些问题,概率配准方法应运而生,为fNIRS数据空间配准开辟了新方向。
概率配准法借助存储在参考数据库中的MRI,而非受试者自身的MRI,将fNIRS探头或通道位置概率性地配准到标准脑模板上。研究人员先构建一个参考数据库,包含多个个体的头部和大脑MRI,以及这些个体在MNI空间中的10 – 20标准位置。
进行配准时,用3D数字化仪获取受试者头部fNIRS通道坐标,以10 – 20标准位置为标记点,通过仿射变换将其转换到参考数据库的MNI空间,再把头部表面点注册到对应的皮层表面。这样就能得到给定fNIRS通道在皮层表面的多主体分布,以及最可能的估计值和代表误差的cSD。当fNIRS探头在头皮上的放置具有可重复性时,该方法的cSD能控制在毫米量级,对于脑回水平的功能映射研究来说,精度足够。
传统概率配准方法需要至少四个不同的头皮参考标记点,但确定第四个标记点比较困难。为此,研究人员开发了基于锚点的概率配准方法。该方法利用鼻根和左右耳前点这三个颅骨标记点,再加上一个可从头皮任意位置获取的锚点进行仿射变换。通过三个颅骨标记点定义平面和球面坐标系,将参考点转换到参考头部的头皮,再利用参考头部到MNI空间的变形场把锚点转换到MNI空间。实验显示,基于锚点的概率配准方法与传统概率配准方法以及基于SPM与个体自身MRI配准的方法相比,准确性相当,且操作更简便,减轻了实验负担,特别适合临床研究场景。
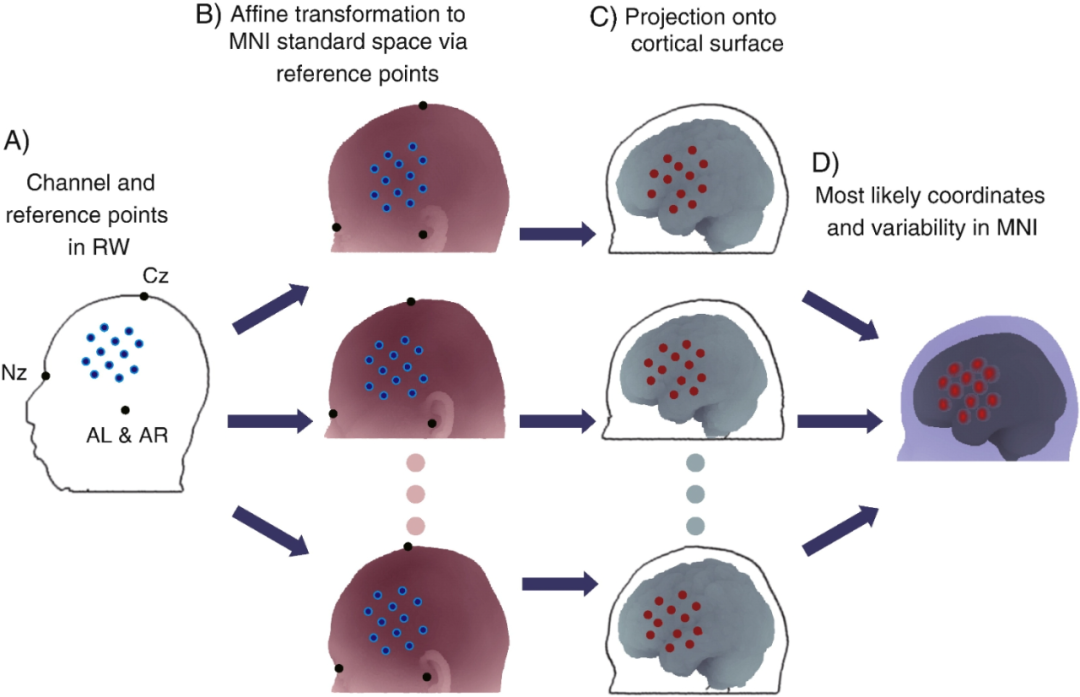


无磁共振成像(MRI)情况下的单受试者数据概率配准。(A)使用三维数字化仪测量真实世界(RW)空间中通道和参考点的位置。参考点的最少数量为四个,就像在这种情况下,使用了Nz(鼻根点)、Cz点以及左右耳前点(AL和AR)。或者,也可以使用全部或选定的10/20系统的点位。(B)将真实世界空间中的参考点通过仿射变换,对应到MNI空间中参考MRI数据库里每个条目中的相应参考点上。(C)将头皮上的通道投影到参考大脑的皮层表面。(D)对投影到皮层上的通道位置进行整合,从而得出在MNI空间中最可能的坐标(平均值:球体中心)以及变异性(综合标准差:球体半径)。
七、概率配准在DOT中的应用:拓展技术边界
漫射光学断层扫描(DOT)作为fNIRS的断层成像变体,利用大量光源和探测器重建大脑激活的三维图像。它能提供深度分辨率,区分头皮和大脑深层信号,空间分辨率不断提升,甚至可构建详细的视野视网膜拓扑图,在大脑功能研究中极具潜力。
但DOT通常需要受试者特定的头部解剖空间先验信息,这依赖结构MRI,并需进行额外的分割、配准和图像重建,计算量很大,与fNIRS的经济便利优势相悖。概率配准方法为解决这一矛盾提供了思路。
研究人员尝试用标准图谱(如Colin27)替代受试者自身的MRI。通过概率配准将图谱注册到受试者头部表面,再解决光子迁移正向问题来重建光学图像。实验表明,使用注册图谱重建的DOT图像在定位激活焦点方面与使用受试者特定大脑解剖结构重建的图像效果相近。虽然存在一定定位误差,但对于脑回水平的推断仍有实用价值。而且,基于GPU的蒙特卡罗算法加速了光子迁移模拟,使得基于图谱的DOT技术计算成本不再是大问题,有望得到更广泛应用。
八、虚拟配准:简化流程的创新尝试
虽然3D数字化仪配准方法在无受试者自身MRI时也能实现fNIRS通道数据到MNI坐标空间的配准,但该方法需精确测量10 – 20标记点和探头位置,给受试者带来负担,限制了其在临床等场景的应用。
为解决这些问题,研究人员开发了无需3D数字化仪的虚拟配准方法。该方法在探头支架定位和变形可重复的前提下,通过模拟支架变形,把虚拟探头支架放置在头皮上,再将探头和通道注册到参考大脑上,取代对受试者大脑的直接依赖。
研究人员先构建了商用探头支架的变形算法,然后在代表正常成人大脑和头部大小形状变化的合成模型上模拟虚拟支架的注册,并将注册位置归一化到MNI空间。通过多次重复模拟(如一千次),统计估计最可能的MNI坐标值和估计误差。实验结果显示,该方法的标准偏差在头皮上也在毫米量级,实现了独立fNIRS数据到MNI空间的空间配准。
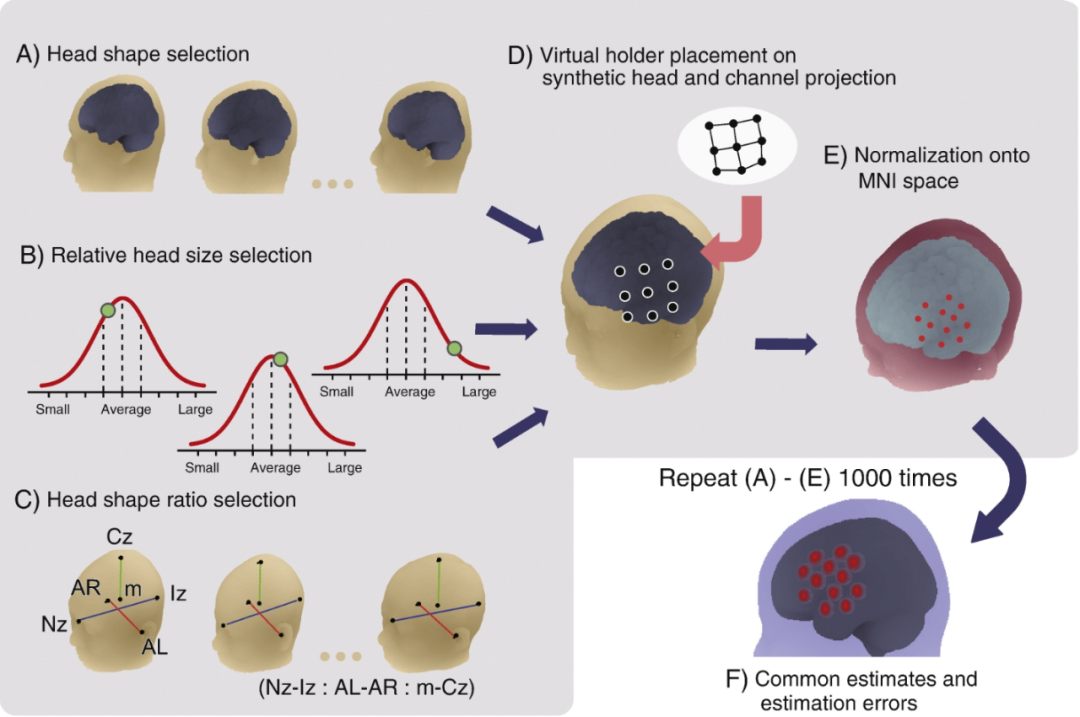


无需磁共振成像(MRI)或三维数字化仪的多受试者数据虚拟配准。通过对参考 MRI 进行重采样来创建一个合成的头部和大脑模型,以提供整体的头部和大脑形状(图 A)、相对头部大小(图 B)以及头部形状比例(图 C)。在图 C 中,m 表示右耳前点(AR)、左耳前点(AL)、鼻根点(Nz)和枕外隆凸点(Iz)的重心。在合成头部上,基于探头支架的变形和放置具有可重复性这一假设,放置一个虚拟的功能性近红外光谱(fNIRS)探头支架(图 D)。从 fNIRS 探头(图 D 中的黑点)出发,将通道定义为探头间的中点。将这些通道投影到合成大脑上,并归一化到 MNI 空间中(图 E)。重复这一过程一千次,以得出最可能的估计值(平均值:红色圆圈的中心)和估计误差(综合标准差:圆圈的半径)。
不过,该方法对探头支架的放置和形状描述要求较高。为简化操作,研究人员创建了成人受试者常见探头放置的虚拟配准库,提供fNIRS通道的MNI坐标和宏观解剖估计。这使得研究人员在使用虚拟配准方法时更加便捷,降低了操作难度。
九、软件实现:让技术落地生根
随着fNIRS应用日益广泛,对数据处理软件的需求也越来越大。目前,有三个主要的基于Matlab的免费软件包,它们都集成了概率配准工具,可对独立的fNIRS数据进行到MNI空间的空间配准。
HomER2是一款集成的fNIRS数据处理工具,拥有用户友好的图形用户界面(GUI)。它预设了10 – 20标记点,用户能通过GUI轻松设计探头布局,还兼容3D数字化仪,可进行通道分析和重建连续图像的概率配准。此外,HomER2提供丰富的数据处理“食谱”,方便用户进行灵活的时空数据分析,满足不同研究需求。
NIRS-SPM提供fNIRS的统计参数映射工具,可通过非均匀样条插值核从离散通道数据生成连续图像数据。处理独立fNIRS数据时,NIRS-SPM利用概率配准将功能图像转换到MNI空间,并采用多种统计方法对个体和群体数据进行处理,为研究人员提供了强大的数据分析能力。
Platform for Optical Topography Analysis Tools(POTATo)则侧重于提供灵活的调制能力。它没有标准化程序,但和HomER2一样提供“食谱”,用户可根据需求轻松整合新的自定义功能。概率配准和虚拟配准工具箱能稳定集成到POTATo中,用户可按需处理通道数据或连续图像数据,进行个体和群体分析。
研究人员还在网站上提供概率配准的基本Matlab函数工具箱,方便开发者将其集成到自己的软件包中。有Matlab基础的用户也可直接使用这些原生工具箱,但对大多数用户来说,通过上述软件包使用概率配准工具更为便捷。
十、儿童与婴儿数据配准:挑战与希望并存
在fNIRS研究中,儿童和婴儿数据的配准是一个充满挑战但又至关重要的领域。目前,还没有成熟的标准立体定向系统用于处理婴儿大脑数据,但近年来已经取得了一些重要进展。
研究人员开发了多种年龄段的概率脑模板,如基于76名9 – 15个月大婴儿MRI数据的模板,以及针对新生儿到4岁儿童、29 – 44孕周婴儿大脑、4.5 – 18.5岁儿童的特定模板,这些模板可以对灰质、白质和脑脊液进行分割。还有研究创建了平均形状图谱,通过将多个新生儿大脑对齐到MNI空间并进行迭代仿射和非线性变换后平均得到,但图谱与宏观解剖结构的对应关系尚不清楚。
由于新生儿和婴儿大脑的MRI图像对比度较低,在2岁之前进行稳定的宏观解剖分割非常困难。目前只有在2岁时才能较为成功地进行脑叶水平的分割,脑回水平的分割还需要进一步研究。在实际研究中,由于缺乏适合婴儿和幼儿的解剖图谱,研究人员尝试将成人图谱外推到幼儿大脑。例如,Shi等人创建了纵向变形场,将成人大脑转换为婴儿大脑,并将AAL投影到新生儿、1岁和2岁儿童的大脑上。
研究人员还基于婴儿和儿童皮层与成人相对宏观解剖结构模式相似的假设,应用概率或虚拟配准程序将头皮fNIRS通道转换到MNI空间的皮层模板上,并通过实验验证了这种方法在宏观解剖上的可比性。但这种方法并非最优解。为了更好地利用fNIRS开展儿科发育功能神经成像研究,需要建立和验证代表不同发育阶段的脑模板,并使其与MNI坐标系兼容。
目前已有的模板与MNI空间的兼容性存在差异,且缺乏满意的宏观解剖图谱。未来需要建立不同系统之间的整合或链接,也可以考虑在相对头皮坐标系中标准化空间数据,利用球形坐标系或国际10 – 20系统及其衍生系统来表达头皮和皮层位置,这可能需要手动追踪脑回水平的宏观解剖结构,虽然具有一定难度,但随着相关技术的发展,有望取得实质性进展。
十一、结语:技术融合,未来可期
经过多年发展,fNIRS技术已在神经成像领域站稳脚跟,但也面临着空间配准等技术难题。空间配准技术作为fNIRS与其他神经成像技术沟通的桥梁,对推动fNIRS发展和神经科学研究意义重大。
随着技术的不断进步,我们有理由相信,fNIRS的空间配准技术将不断完善。未来,更精准、便捷的配准方法将不断涌现,适用于特殊人群(如儿童、婴儿)的配准技术也将取得突破。fNIRS与其他神经成像技术的融合将更加紧密,为我们揭示大脑奥秘提供更强大的工具。在技术融合的推动下,神经科学研究有望取得更多突破性成果,为人类健康和认知发展带来新的曙光。
十二、关于作者
續木大介



高知大学教育研究部自然科学系理工学部门讲师。
H指数26,被引量4780。
研究方向:生命科学/神经科学、计算机视觉。
来源:https://researchers.kochi-u.ac.jp/DET01_G01/DET01_G01View/2694
http://tsuzuki.gomen.org/
檀一平太



中央大学理工学院综合人机工学系应用认知神经科学实验室教授。
H指数45,被引量11385。
以下是其实验室信息:
本实验室于2013年4月新成立,传承了自治医科大学功能性脑科学实验室以及日本筑波国立食品研究所感官与认知食品科学实验室的研究传统。我们开展多学科交叉研究,结合功能性近红外光谱技术(fNIRS)进行功能性脑成像,并运用心理测量学研究人类认知,特别关注“食生活”与“食品市场营销”等主题。
在功能性脑成像方面,我们尤其致力于fNIRS成像(亦称光学脑成像或弥散光学成像,DOI)空间定位技术的开发。目前已有若干实用工具,并在学术期刊上发表了相关成果,具有扎实的证据基础。
实验室的另一项核心研究方向是心理测量学。为什么选择心理测量学?因为单靠神经影像技术还不足以揭示人类认知的复杂结构。我们需要通过不断提问与收集数据,借助严谨的统计分析来揭示大脑中的真实运作机制。目前,我们将心理测量方法应用于人类“食生活”研究,并逐步扩展至整体生活质量(QoL)领域。
从我们的发表成果可以看出,我们非常欢迎在上述任一研究方向上开展国际合作。如果您感兴趣,欢迎随时联系我们:dan(at mark)jichi.ac.jp。
此外,我们的实验室位于东京市中心,热情欢迎您的来访,即使是临时预约也通常没问题!
来源:https://brain-lab.jp/wp/?page_id=42
如有侵权,请联系我们删除!
公司简介



北京恒挚科技有限公司是一家专注于前沿科技的创新型高新技术企业,深耕脑科学、神经管理、人因工程、生物力学、拟态环境及XR仿真现实等多学科交叉领域。公司由中科(广东)科学集团投资,依托广东人因技术研究院与武汉人因工程技术研究院的科研力量,构建了集研发、生产、销售及技术服务于一体的专业化运营体系,为客户提供一站式、高质量的科技解决方案。
凭借卓越的创新能力,恒挚科技已荣获多项发明专利、软件著作权和注册商标,入选国家高新技术企业等多项权威名单,并参与国家标准和团体标准的编制。公司长期服务于高校及科研院所,与中国人类工效学学会、中国心理学会、中国建筑学会等多个国家级学会深度合作,每年组织与参与40余场学术会议,推动技术交流与行业发展。
恒挚科技秉持“科技赋能、创新驱动”的理念,致力于成为行业领先的科技企业,助力国家科技进步与社会发展,携手各界伙伴共赴科技赋能的美好未来。